Под качество природной воды в целом понимается характеристика ее состава и свойств, определяющая ее пригодность для конкретных видов водопользования (ГОСТ 17.1.1.01-77), при этом критерии качества представляют собой признаки, по которым производиться оценка качества воды.
Органолептические показатели
Любое знакомство со свойствами воды начинается с определения органолептических показателей, т.е. таких, для определения которых мы пользуемся нашими органами чувств (зрением, обонянием, вкусом).
Органолептическая оценка приносит много прямой и косвенной информации о составе воды. К таким характеристикам относятся: цветность, мутность (прозрачность), запах, вкус, привкус.
Мутность и прозрачность
Мутность воды вызвана присутствием тонкодисперсных примесей, обусловленных нерастворимыми или коллоидными неорганическими и органическими веществами различного происхождения.
Качественное определение проводят описательно: мутность не заметна (отсутсвует), слабая опалесценция (Прим.1) , опалесценция, слабомутная, мутная или сильно мутная. В России мутность чаще всего измеряют в нефелометрических единицах мутности НЕФ (NTU) для небольших значений в пределах 0-40 НЕФ (NTU), например для питьевой воды. В условиях большой мутности обычно применяется измерение единиц мутности по формазину (ЕФМ). Пределы измерений - 40-400 ЕФМ.
Когда вода имеет незначительные окраску и мутность, и их определение затруднительно, пользуются показателем "прозрачность".
Мера прозрачности - высота столба воды, при которой можно наблюдать опускаемую в воду белую пластину определенных размеров (диск Секки) или различать на белой бумаге шрифт определенного размера и типа (шрифт Снеллена). Результаты выражаются в сантиметрах (табл.1)
Таблица 1. Характеристика вод по прозрачности
|
Прозрачность |
Единица измерения, см |
|
Прозрачная |
Более 30 |
|
Маломутная |
От 25 до 30 |
|
Средней мутности |
От 20 до 25 |
|
Мутная |
От 10 до 20 |
|
Очень мутная |
Менее 10 |
Мутность не только отрицательно влиет на внешний вид воды. Главным отрицательным следствием высокой мутноти является то, что она защищает микроорганизмы при ультрафиолетовом обеззараживании и стимулирует рост бактерий. Поэому во всех случаях, когда производится дезинфекция воды, мутность должна быть минимальной для обеспечения высокой эффективности этой процедуры. В соответсвии с гигиеническими требованиями к качеству питьевой воды мутность не должна превышать 1,5 мг/л по каолину.
Запах
По характеру запахи делятся на две группы:
- естественного происхождения (живущие и отмершие в воде организмы, загнивающие растительные остатки и др.);
- искусственного происхождения (примеси промышленных и сельскохозяйственных сточных вод).
Интенсивность запаха оценивают по шестибальной шкале (табл.2)
Таблица 2. Характеристика вод по интенсивности запаха
|
Интенсивность запаха, баллы |
Характеристика |
Описательные определения |
|
0 |
Запаха нет |
Отсутствие ощутимого запаха |
|
1 |
Очень слабый |
Запах, не замечаемый потребителем, но обнаруживаемый опытным исследователем |
|
2 |
Слабый |
Запах, не привлекающий внимания потребителя, но обнаруживаемый им, если указать на него |
|
3 |
Заметный |
Запах, легко обнаруживаемый и могущий дать повод относиться к воде с неодобрением |
|
4 |
Отчетливый |
Запах, обращающий на себя внимание и делающий воду неприятной для питья |
|
5 |
Очень сильный |
Запах, сильный настолько, что делает воду непригодной для питья |
Таблица 3. Запахи естественного происхождения
|
Обозначение запаха |
Характер запаха |
Примерный род запаха |
|
А |
Ароматический |
Огуречный, цветочный |
|
Б |
Болотный |
Илистый, тинистый |
|
Г |
Гнилостный |
Фекальный, сточный |
|
Д |
Древесный |
Запах морской щепы, древесной коры |
|
З |
Землистый |
Прелый, запах свежевспаханной земли, глинистый |
|
П |
Плесневый |
Затхлый, застойный |
|
Р |
Рыбный |
Запах рыбьего жира, рыбы |
|
С |
Сероводородный |
Запах тухлых яиц |
|
Т |
Травянистый |
Запах скошенной травы, сена |
|
Н |
Неопределенный |
Запахи естественного происхождения, не подходящие под предыдущие определения |
Запахи второй группы (искуственного происхождения) называют по определяющим запах веществам: хлорный, бензиновый и т.д.
Вкус и привкус
Интенсивность вкуса и привкуса определяется также по 6-балльной шкале (табл.4)
Таблица 4. Характеристика вод по интенсивности вкуса
|
Оценка вкуса и привкуса, баллы |
Интенсивность вкуса и привкуса |
Характер проявления вкуса и привкуса |
|
0 |
Нет |
Вкус и привкус не ощущается |
|
1 |
Очень слабая |
Вкус и привкус сразу ощущается потребителем, но обнаруживаются при тщательном тестировании |
|
2 |
Слабая |
Вкус и привкус замечаются, если обратить на это внимание |
|
3 |
Заметная |
Вкус и привкус легко замечаются и вызывают неодобрительный отзыв о воду |
|
4 |
Отчетливая |
Вкус и привкус обращают на себя внимание и заставляют воздержаться от питья |
|
5 |
Очень сильная |
Вкус и привкус настолько сильны, что делают воду непригодной к употреблению |
Для питьевой воды допускаються значения показателй вкуса и привкуса не более 2 баллов.
Различают 4 вид вкусов:
- соленый
- горький
- сладкий
- кислый
Качественную характеристику оттенков вкусовых ощущений - привкуса - выражают описательно: хлорный, рыбный, горьковатый и так далее. Наиболее распространенный соленый вкус воды чащу всего обусловлен растворенным в воде хлоридом натрия, горький - сульфатом магния, кислый - избытком свободного диоксида углерода и т.д.
Цветность
Показатель качества воды, характеризующий интенсивность окраски воды и обусловленный содержанием окрашенных соединений, выражается в градусах платино-кобальтовой шкалы и определяется путем сравнения окраски испытуемой воды с эталонами.
Цветность природных вод обусловлена главным образом присутсвием гумусовых веществ и соединений трехвалентного железа, колеблется от единиц до тысяч градусов (табл.5)
Таблица 5. Характеристика вод по цветности
|
Цветность |
Единицы измерения, градус платино-кобальтовой шкалы |
|
Очень малая |
До 25 |
|
Малая |
Более 25 до 50 |
|
Средняя |
Более 50 до 80 |
|
Высокая |
Более 80 до 120 |
|
Очень высокая |
Более 120 |
Взвешенные примеси
Взвешенные твердые примеси, присуствующие в природных водах, состоят из частиц глины, песка, ила, суспедированных органических и неорганических веществ, планктона и различных микроорганизмов. Взвешенные частицы влияют на прозрачность воды.
Содержание в воде взвешенных примесей, измеряемое в мг/л, дает представление о загрязненности воды частицами, в основном, условным диаметром более 10 (в -4 степени) мм.
Водородный показатель (рН) 
Величина рН воды - один из важнейших показателей качества вод для определения тсабильности воды, ее накипеобразующих и коррозионных свойств, прогнозирования химических и биологических процессов, происходящих в природных водах. В зависимости от рН воду рационально делить на семь групп (табл.6)
Таблица 6. Классификация вод по рН
|
Группа воды |
рН |
|
Сильнокислая |
Менее 3,0 |
|
Кислая |
Более 3,0 до 5,0 |
|
Слабокислая |
Более 5,0 до 6,5 |
|
Нейтральная |
Более 6,5 до 7,5 |
|
Слабощелочная |
Более 7,5 до 8,5 |
|
Щелочная |
Более 8,5 до 9,5 |
|
Сильнощелочная |
Более 9,5 |
От величины рН зависит развитие и жизнедеятельность многих организмов, агрессивное действие воды на металлы и бетон. Величина рН воды также влияет на процессы превращения различных форм биогенных элементов, изменяет токсичность загрязняющих веществ.
В соответсвии с требованиями к составу и свойствам питьевой воды, величина рН не должна выходить за пределы интервала значений 6,0-9,0. Контроль уровня рН особенно важен на всех стадиях водоочистки, так как его "уход" в ту или иную сторону может не только существенно сказаться на запахе, привкусе и внешнем виде воды, но и повлиять на эффективность водоочистных мероприятий.
При низком рН вода обладает высокой коррозионной активностью, а при высоких уровнях (рН>11) вода приобретает характерную мылкость, неприятный запах, вызывает раздражение глаз и кожи.
Минерализация
Минерализация - суммарное содержание всех найденных при химическом анализе воды минеральных веществ. Минерализация природных вод, определяющая их удельную электропроводность, изменяется в широких пределах. Большинство рек имеет минерализацию от нескольких десятков миллиграммов в литре до нескольких сотен. Их удельная электропроводимость варьируется от 30 до 1500 мкСм/см. Минерализация подземных вод и соленых озер изменяется в интервале от 40-50 мг/л до сотен г/кг (плотность в этом случае уже значительно отличается от единицы). Удельная электропроводимость атмосферных осадков с минерализацией от 3 до 60 мг/л составляет значения 10-120 мкСм/см.
Таблица 7. Характеритика вод по минерализации 
|
Группа воды |
Единица измерения, г/л |
|
Пресные |
До 1 |
|
Солоноватые |
Более 1 до 25 |
|
Соленые |
Более 25 до 50 |
|
Рассолы |
Более 50 |
Предел пресных вод - 1 г/л - установлен в связи с тем, что при минерализации более этого значения вкус воды неприятен - соленый или горько-соленый.
Предел - граница между солоноватыми и солеными водами - принят на том основании, что при минерализации около 25 г/л температура замерзания воды и температура наибольшей плотности морской воды совпадают, и при этом меняются некоторые свойства воды.
Граница 50 г/л между солеными водами и рассолами обусловлена тем, что соленость больше этого значения не бывает в морях; Такая соленость характерна только для соленых озер и некоторых подземных вод.
Таблица 8. Характеристика вод по общей минерализации (наиболее распространеннная градация) 
|
Наименование воды |
Общая минерализация, г/л |
|
Ультрапресная |
До 0,1 |
|
Пресная |
Более 0,1 до 1,0 |
|
Слабопресная |
Более 1,0 до 3,0 |
|
Соленая |
Более 3,0 до 10,0 |
|
Сильносоленая |
Более 10,0 до 50,0 |
|
Рассол |
Более 50,0 до 300,0 |
|
Ультрарассол |
Более 300,0 |
В соответствии с гигиеническими требованиями к качеству питьевой воды суммарная минерализация не должна превышать 1000 мг/л. Вода содержащая большое количество солей, отрицательно влияет на растения и человека, вызывает образование накипи на стенках котлов, коррозию, засоление почв. Регулярное употребление высокоминерализированной воды приведет к болезням пищеварения, обмена веществ, повышеной сухости кожи.
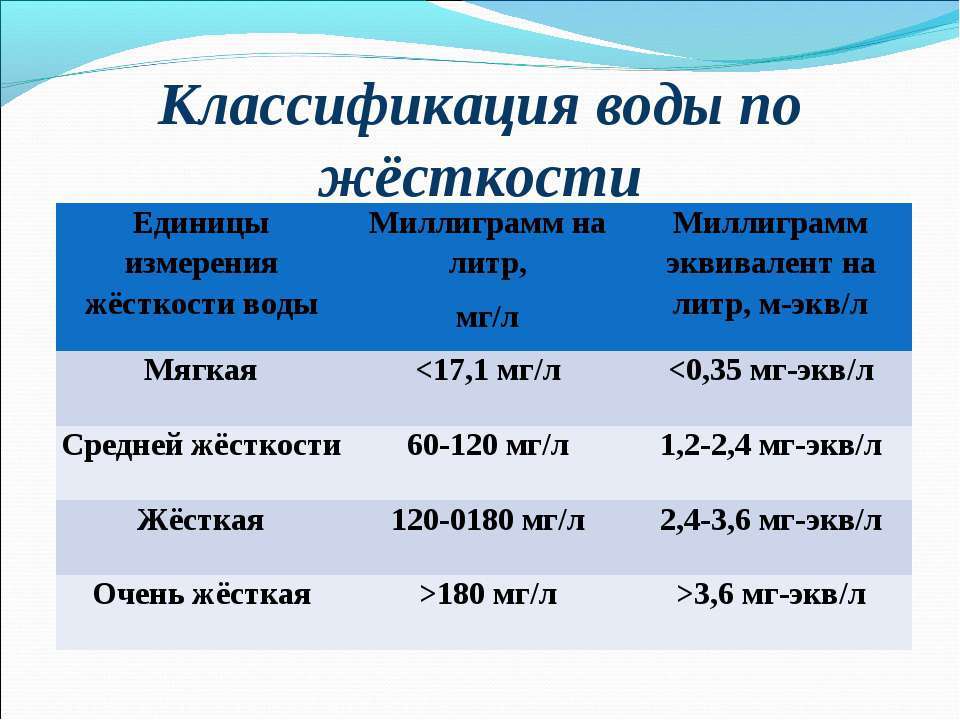
Жесткость
Жесткость воды обуславливается наличием в воде ионов кальция, магния, стронция, бария, железа, марганца. Но общее содержание в природных водах ионов кальция и магния несравнимо больше содержания всех других перечисленных ионов - и даже их суммы. Поэтому под жесткостью понимают сумму количеств ионов кальция и магния - общая жесткость, складывающаяся из значений карбонатной (временной, устраняемой кипячением) и некарбонатной (постоянной) жесткости. Первая вызвана присутствием в воде гидрокарбонатов кальция и магния, вторая - наличием сульфатов, хлоридов, силикатов, нитратов и фосфатов этих металлов. Однако при значении жесткости воды более 9 ммоль/л нужно учитывать содержание в воде стронция и других щелочноземельных металлов.
По стандарту ИСО 6107-1-8: 1996, включающему более 500 терминов, жесткость определяется как способность воды образовать пену мылом. Содержание в питьевой воде кальция и магния играет важнейшую роль для человеческого организма. Недостаточность кальция в организме негативно сказывается на функии сердечной мышцы и на активности некоторых ферментов. А недостаток содержания кальция в крови ведет к понижению возбуждаемости нервной системы и, как следствие, к возникновению судорог. Кальций необходим для формирования костных тканей, в том числе зубов. Соли магния тоже необходимы человеку, поскульку входят в ряд жизненно важных ферментов. Дефицит магния проводит к коронарной болезни сердца; с другой стороны, повышенное содержание магния угнетающе действуют на нервную систему, поражая двигательные нервные окончания.
По значению общей жесткости природные воды делят на группы (табл.9)
Таблица 9. Классификация воды по жесткости
|
Группа воды |
Единица измерения, ммоль/л |
|
Очень мягкая |
До 1,5 |
|
Мягкая |
Более 1,5 до 4,0 |
|
Средней жесткости |
Более 4 до 8 |
|
Жесткая |
Более 8 до 12 |
|
Очень жесткая |
Более 12 |
В естественных условиях ионы кальция и магния определяющие жесткость, поступают в воду в результате взаимодействия растворенного диоксида углерода с карбонатными минералами и других процессов растворенияи химического выветривания горных пород. Источником этих ионов являются также микробиологические процессы, протекающие в почвах. Обычно преобладает жесткость, обусловленая ионами кальция (до 70%); однако в отдельных случаях магниевая жесткость может достигать 50-60%. Жесткость морской воды и океанов значительно выше (десятки ммоль/л). Жесткость поверхностных вод подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего - в период половодья.
Росстандартом в качестве единицы жесткости воды установлен моль на кубический метр (моль/м3). Один моль на кубический метр соответствует массовой концентрации эквивалентов ионов кальция 20,04 г/м3 (мг/л) или ионов магния 12,153 г/м3 (мг/л). Т.е., 1 моль/м3 = 1 ммоль/л = 1 мг-экв/л - 1 мг-экв/дм3 . В зарубежных странах широко используются такие единицы жесткости, как немецкий градус (do, dH), французский градус (fo), американский градус (ppm CaCO³).
Основные единицы жесткости воды и их соотношение:
|
Моль/м3 (мг-экв/л)
|
Немецкий градус, do |
Французский градус,fo |
Английский градус |
Американский градус |
gpg (grain per gallon, или грэйн/галлон) |
Ppm (мг/л) CaCO3 |
|
1.000 |
2.804 |
5.005 |
3.511 |
50.050 |
2.920 |
50.050 |
Прим.1 Опалесценция - "[опал + лат. -escenua суффикс, означающий слабое действие] — физ. явление рассеяния света мутной средой, обусловленное ее оптической неоднородностью; наблюдается, напр. , при освещении большинства коллоидных растворов, а также у веществ в критическом состоянии
Опалесценция критическая - резкое усиление рассеяния света чистыми веществами (газами или жидкостями) в критических состояниях, а также растворами при достижении ими критических точек смешения.
Повышенная жесткость воды негативно отражается на здоровье человека. В быту появление накипи приводит к уменьшению срока слыжбы водонагревателей, ухудшаются моющие свойства мыла и стиральных порошков, из-за горьковатого привкуса ухудшаются вкусовые свойства воды.
Порог вкуса для иона кальция лежит в диапазоне 2-6 ммоль/л, в зависимости от соответствующего аниона. Порог вкуса для магния и того ниже, наилучшие вкусовые свойства имеет вода с жсткостью 1,6-3,0 ммоль/л.
Всемирная организация здравоохранения (ВОЗ) не регламентирует величину жесткости по показаниям влияния на здоровье. В материалах ВОЗ говориться о том, что несмотря на выявленную статистическим путем зависимость между жесткостью питьевой воды и сердечно-сосудистыми заболеваниями, этих данных недостаточно для вывода о причинном характере этой связи. Однозначно не доказано и то, что мягкая вода оказывает отрицательный эффект на баланс минеральных веществ в организме человека.
Растворенный кислород 
Поступление кислорода в водоем происходит путем растворения его при контакте с воздухом (абсорбции), а также в результате фотосинтеза водными растениями, т.е. в результате физико-химических и биохимических процессов. Содержание растворенного кислорода зависит от температуры, атмосферного давления, степени турбулизации воды*, минерализации воды и др. В поверхностных водах содержание растворенного кислорода может колебаться от 0 до 14 мг/л и подвержено значительным сезонным суточным колебаниям. В зимний и летний периоды количество кислорода в воде различается. Дефицит кислорода чаще наблюдается в водных объектах с высокими концентрациями загрязняющих органических веществ и в водоемах, содержащих большое количество биогенных и гумусовых веществ. ПДК растворенного в воде кислорода для рыбохозяйственных водоемов - 6 мг/л (для ценных пород рыбы) и 4 мг/л (для остальных пород рыбы).
Скорость потребления кислорода увеличивается с повышением температуры, количества организмов и веществ, подвергающихся химическому и биохимическому окислению.
Концентрация кислорода в воде определяет направление и скорость процессов химического и биохимического окисления органических и неорганических соединений. Понижение содержания кислорода до 2 мг/л вызывает массовую гибель рыбы в водоемах. Неблагоприятно сказывается на состоянии водных объектов и чрезмерное насыщение воды кислородом в результате процессов фотосинтеза, если это происходит в водоемах с застойной водой.
Содержание кислорода в водоемах с различной степенью загрязненности:
Таблица 10. Уровень загрязнения воды и класс качества
| Растворенный кислород | |||
| Очень чистые, I | лето, мг/л | зима, мг/л | % насыщения |
| Чистые, II | 9 | 14-13 | 95 |
| Умеренно загрязненные, III | 8 | 12-11 | 80 |
| Загрязненные, IV | 7-6 | 10-9 | 70 |
| Грязные, V | 5-4 | 5-4 | 60 |
| Очень грязные, VI | 3-2 | 5-1 | 30 |
| 0 | 0 | 0 | |
*Турбулизация приводит к нарушению поверхностного натяжения воды. При этом разрывается поверхностная пленка и облегчается выход газов из воды. Благодаря турбулентному движению происходит перемешивание частиц воды и непрерывное обновление поверхности соприкосновения воды с паром. Это ускоряет выход газа из воды и переход его в пар. Турбулизация движения воды создается потоком пара, пересекающим струи воды.
Биогенные элементы
Вопросы контроля качества воды внесли в понятие биогенных элементов широкий смысл: к ним относят соединения (точнее, компоненты воды), которые, во-первых, являются продуктами жизнедеятельности различных организмов; во-вторых, являются "строительным материалом" для живых организмов. В первую очередь к ним относятся соединения азота (нитраты, нитриты, органические и неорганические аммонийные соединения), фосфора (ортофосфаты, полифосфаты, органические эфиры фосфорной кислоты и др.).
Соединение серы интересны в этой связи,в меньшей степени, так как сульфаты уже расматривали в аспекте компонента минерального состава воды, а сульфиды и гидросульфиты, если приутствуют в природных водах, то в очень малых концентрациях и могут быть обнаружены по запаху.
Нитраты
 Нитраты являются солями азотной кислоты. Повышенное содержание нитратов в воде может служить индикатором загрязнения водоема в результате распространения фекальных либо химических загрязнений (сельскохозяйственных, промышленных). Согласно СанПин 2.1.4.1074-01 для питьевой воды ПДК нитратов составляет 45 мг/л. Питьвая вода и продукты питания, содержание повышенное количество нитратов, могут вызывать заболевания, в первую очередь у младенцев (так называемая метгемоглобинемия), а также людей, страдающих сердечно-сосудистыми заболеваниями. Допустимое суточное потребление по рекомендациям ВОЗ - 5 мг/кг массы. В этом случае особенно опасны грунтовые воды и питаемые ими колодцы, поскольку в открытых водоемах нитраты частично потребляются водными растениями. Вместе с тем, растения не так чувствительны к увеличению содержания в воде азота, как фосфора.
Нитраты являются солями азотной кислоты. Повышенное содержание нитратов в воде может служить индикатором загрязнения водоема в результате распространения фекальных либо химических загрязнений (сельскохозяйственных, промышленных). Согласно СанПин 2.1.4.1074-01 для питьевой воды ПДК нитратов составляет 45 мг/л. Питьвая вода и продукты питания, содержание повышенное количество нитратов, могут вызывать заболевания, в первую очередь у младенцев (так называемая метгемоглобинемия), а также людей, страдающих сердечно-сосудистыми заболеваниями. Допустимое суточное потребление по рекомендациям ВОЗ - 5 мг/кг массы. В этом случае особенно опасны грунтовые воды и питаемые ими колодцы, поскольку в открытых водоемах нитраты частично потребляются водными растениями. Вместе с тем, растения не так чувствительны к увеличению содержания в воде азота, как фосфора.
Фосфаты и общий фосфор
Фосфор является необходимым элементом для жизни, однако его избыток приводит к ускорению эвтрофикации водоемов**. Большие количества форсфора могу попадать в водоемы в результате естесственных и антропогенных процессов - поверхностной эрозии почв, неправильного или избыточного применения минеральных удобрений и др.
ПДК полифосфатов в воде водоемов составляет 3,5 мг/л в пересчете на фосфат-ион РО4-3 , лимитирующий показатель вредности - органолептический.
Биохимическая потребность в кислороде (БПК)
БПК - показатель качества воды, характеризующий суммарное содержание в воде органических веществ. Природными источниками органических веществ являются разрушающиеся останки организмов растительного и животного происхождения, как живших в воде, так и попавших в водоем с листвы, по воздуху, с берегов и т.п. Кроме природных, существуют также техногенные источники органических веществ.
В естественных условиях находящиеся в воде органические вещества разрушаются бактериями с образованием двуокиси углерода. При этом на окисление потребляется растворенный в воде кислород. Таким образом, в процессе биохимического окисления органических веществ в воде происходит уменьшение концентрации кислорода, и эта убыль косвенно является мерой содержания в воде органических веществ.
Чаще определяют биохимическое потребление кислорода за пять суток - БПК5, и, как правило, этот показатель в поверхностных водоемах находится в пределах 0,5-4,0 мг/л.
Таблица 11. Характеристика вод по БПК5
| Степень загрязнения (класс чистоты) | БПК5, мг О2/дм3 |
| Очень чистая |
0,5-1,0 |
| Чистая | 1,1-1,9 |
| Умеренно загрязненная | 2,0-2,9 |
| Загрязненная | 3,0-3,9 |
| Грязная | 4,0-10,0 |
| Очень грязная | Более 10,0 |
Особенностью биохимического окисления органических веществ в воде является сопутствующий ему процесс нитрификации (окисление азотосодержащих соединений нитрофицирующими бактериями), искажающий характер потребления кислорода.
Норматив на БПК для водоемов хозяйственно-питьевого водопользования - 3 мг/л, для водоемов культурно-бытового водопользования - 6 мг/л.
Аммоний
Катионы аммония являются продуктом микробиологического разложения белков животного и растительного происхождения. Образовавшийся таким образом аммоний вновь вовлекается в процесс синтеза белков. По этой причине аммоний и его соединения в небольших концентрациях обычно присутствуют в природных водоемах.
Аммонийные соединения в больших количествах входят в состав минеральных и органических удобрений, кроме того, аммонийные соединения в значительных количествах присутсвуют в нечистотах (фекалиях). По этим причинам повышенное содержание аммонийного азота в поверхностных водах обячно является признаком хозяйственно-фекальных загрязнений.
ПДК аммиака и ионов аммония в воде водоемов составляет 2,6 мг/л. Согласно СанПин 2.1.45.1074-01 ПДК аммония в питьевой воде составляет 2,0 мг/л. По данным ВОЗ, сожержание аммония не должно превышать 0,5 мг/л. Постоянный прием внутрь воды с повышенным содержанием аммония вызывает хронический ацидоз и изменения в тканях.
Нитриты
Нитритами называются соли азотистой кислоты. Нитрит-анионы являются промежуточными продуктами биологического разложения азотсодержащих органических соединений. Благодаря способности превращаться в нитраты, нитриты, как правило, отсутствуют в поверхностных водах. ПДК нитритов (по NO2-) в воде водоемов составляет 3,3 мг/л, для питьевой воды – 2,0 мг/л.
Фтор (фториды)
Фтор в виде фторидов может содержаться в природных и грунтовых водах. Избыток фтора в организме вызывают разрушение зубной эмали, осаждает кальций, что приводит к нарушениям кальциевого и фосфорного обмена. По этим причинам определение фтора в питьевой воде, а также грунтовых водах (например, воде колодцев и артезианских скважин) и воде водоемов хозяйственно-питевого назначения, является очень важным. ПДК фтора в питьевой воде для разных климатических районов составляет от 0,7 до 1,5 мг/л.
Металлы
Железо общее
Железо - один из самых распространенных элементов в природе. Его содержание в земной коре составляет около 4,7 % по массе, поэтому железо, с точки зрения его распространенности в природе, принято называть макроэлементом.
В природной воде железо содержится в виде соединений, в которых железо может быть двух- или трехвалентным. В свою очередь, соединения железа могут образовывать истинные или коллоидные растворы. На воздухе двухвалентное железо быстро окисляется до трехвалентного, растворы которого имеют бурую окраску.
Таким образом, поскольку соединения железа в воде могут существовать в различных формах, точные результаты могут быть получены только при определении суммарного железа во всех его формах, так называемого "общего железа", хотя иногда возникает необходимость определить железо в его индивидуальных формах.
Двухвалентное железо (Fe2+) почти всегда находится в воде в растворенном состоянии, хотя возможны случаи при определенных уровнях рН, когда гидроксид железа (II) выпадает в осадок. Реакция окисления (Fe2+) ⇔ (Fe3+) широко распространена в природе. Трехвалентное железо (Fe3+) - гидроксид железа (III), Fe(OH)3 - нерастворим в воде. Органическое железо встречается в воде в разных формах и в составе разных комплексов. Органические соединения железа, как правило, растворимы или имеют коллоидную структуру и очень трудно поддаются удалению.
Железобактерии встречаются практически везде. Их "визитной карточкой" можно считать ржавую слизь, покрывающие трубу водопровода.
Некоторые виды бактерий (например, Gallionella ferruginea, вид стебельчатых, лентоподобных бактерий) "питаюся" растворенным железом в процессе своей жизнедеятельности. При этом происходит преобразование двухвалентного железа в трехвалентное, которое сохраняется в желеобразной оболочке вокруг бактерии, при отмирании железобактерии откладываются в вышеупомянутой слизи.
Коллоидное железо - это нерастворимые, невидимые глазу частицы размером менее 1 микрона. Из-за малогог размера их очень сложно удалить фильтрованием с помощью гранулированных фильтрующих материалов. Крупные органические молекулы (такие как танины и лигнины) также попадают в эту категорию. Коллоидные частицы из-за своего малого размера и высокого поверхностного заряда, отталкивающего частицы друг от друга и препятсвующие их укрупнению, создают в воде суспензии, которые не выпадают в осадок, а находятся во взвешенном состояни. Коллоидное железо характерно для поверхностных вод (коллоиды Fe(OH)3 ).
Некоторые органические молекулы способны связывать железо в сложные растворимые комплексы, называемые хелатами. Так, прекрасными хелатообразующими агентами являются фульво- и гуминовые кислоты, играющие важную роль в почвенном ионообмене.
Основной формой железа в поверхностных водах являются комплексные соединения трехвалентных ионов железа с растворенными неорганическими и органическими соединениями, главным образом с солями гуминовых кислот - гуматами. В болотных водах, где много гумусовых веществ, всегда много железа. При рН = 8,0 основной формой железа в воде является гидроксид железа Fe(OH)3, находящаяся во взвешенной коллоидной форме. В подземных водах железо присутсвует в основном в растворенном двухвалентном виде. Трехвалентное железо при определенных условиях также может присутсвовать в воде в растворенном виде как в форме неорганических солей (например, сульфатов), так и в составе растворимых органических комплексов.
Согласно СанПин 2.1.4.1074-01 содержание железа не должно превышать 0,3 мг/л (а по нормам Европейского сообщества даже 0,2 мг/л). При уровне установленного ВОЗ переносимого суточного потребления (ПСП) железа, равном 0,8 мг/кг массы тела человека, безопасное для здоровья суммарное содержание железа в воде составляет 2 мг/л. Избыток железа, в первую очередь, оказывает токсичное влияние на печень, селезенку, головной мозг; может усиливать протекание воспалительных процессов.
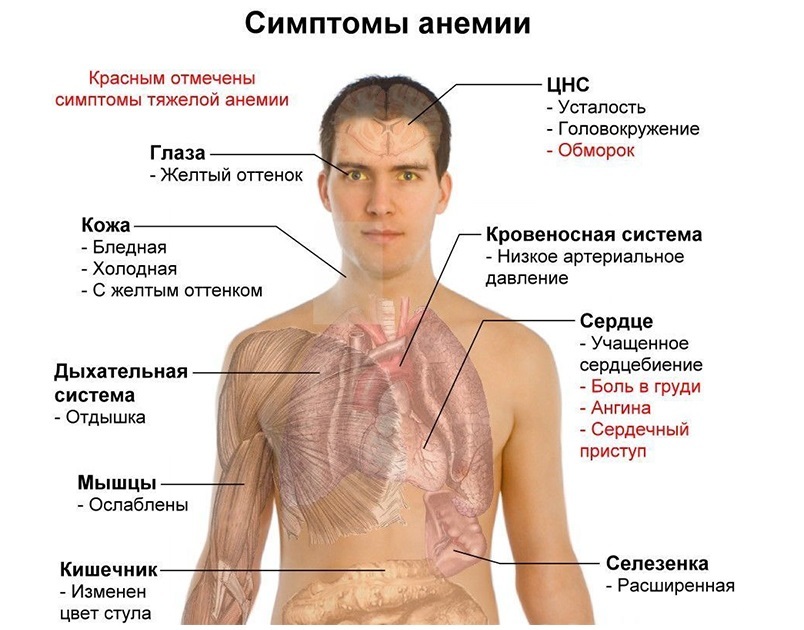
Дефицит железа в организме приводит к анемии, патологиям сердечной мышцы и скелетных мышц, а также может быть причиной снижения иммунитета. Железо незаменимо в процессах кроветворения и внутриклеточного обмена.
Тяжелые металлы
Понятие "Тяжелые металлы" не относится к строго определенным. Разные авторы в составе группы тяжелых металлов указывают разные химические элементы. В экологических публикациях в эту группу включают около 40 элементов с атомной массой более 50 атомных единиц.
Н.Ф.Реймерс относит к тяжелым металлы с плотностью более 8 г/см3, выделяя при этом подгруппу благородных металлов. Таким образом, к собственно "тяжелым" отнесены медь, никель, кадмий, кобальт, висмут, ртуть и свинец.
Группа специалистов, работающая под патронажем Европейской экономической комиссии ООН и занимающаяся мониторингом выбросов в окружающую природную среду тяжелых металлов, включает в эту группу также цинк, мышьяк, селен, сурьму.
Есть и другие классификации. Тяжелые металлы по характеру биологического воздействия можно подразделить на токсиканты и микроэлементы, имеющие принципиально различный характер влияния на живые организмы. Токсиканты оказывают отрицательное воздействие на организмы при любой концентрации, в то время как микроэлементы имеют область недостаточности, вызывющей отрицательный эффект, и область необходимых для жизни концентраций, при превышении которых снова возникает отрицательный эффект. Типичными токсикантами являются: кадмий, свинец, ртуть; микроэлементами - марганец, медь, кобальт.
Медь. Является микроэлементом, содержится в организме человека, главным образом,в виде комплексных органических соединений и играет важную роль в процессах кроветворения. Отравления соединениями меди могут приводить к расстройствам нервной системы, нарушению функций печени, почек и д.т. ПДК меди в воде водоемов хозяйственно-питьевого или культурно-бытового назначения составляет 1,0 мг/л, лимитирующий показатель вредности - органолептический.
Цинк. Является микроэлементом и входит в состав некоторых ферментов. Отрицательное воздействие соединений цинка может выражаться в ослаблении организма, повышенной заболеваемости, астмоподобных явлениях и др. ПДК цинка в воде водоемов составляет 1,0 мг/л, лимитирующий показатель вредности - общесанитарный.
Кадмий. Соединения кадмия очень ядовиты. Действуют на многие системы организма - органы дыхания и желудочно-кишечный тракт, центральную и периферическую нервные системы. ПДК кадмия в воде водоемов составляет 0,001 мг/л, лимитирующий показатель вредности - санитарно-токсикологический.
Ртуть. Относится к ультрамикроэлементам и постоянно присутствует в организме, поступая с пищей. Соединения ртути вызывают глубокие нарушения функцийцентральной нервной системы (ЦНС), сердца, сосудов, нарушение иммунной системы орагнизма и другие. ПДК ртути в воде водоемов составляет 0,0005 мг/л, лимитирующий показатель вредности - санитарно-токсикологический.
Свинец. Соединения свинца - яды, действующие на все живое, но вызывающие изменения особенно в нервной системе, крови и сосудов. Органические соединения свинца (тетраметилсвинец, тетраэтилсвинец) - сильные нервные язы, являются активными ингибиторами обменных процессов. Для всех соединений свинца характерно кумулятивное действие. ПДК свинца в воде водоемов составляет 0,03 мг/л, лимитирующий показатель вредности - санитарно-токсикологический.
Органические вещества
 Спектр органических примесей очень широк:
Спектр органических примесей очень широк:
Группа растворенных примесей:
- гуминовые кислоты и их слои;
- гуматы натрия, калия аммония;
- некоторые примеси промышленного происхождения;
- часть аминокислот и белков;
Группа нерастворенных примесей:
- фульвокислоты (соли) и гуминовые кислоты и их соли;
- гуматы кальция, магния и железа;
- жиры различного происхождения;
- частицы различного происхождения, в том числе микроорганизмы.
Содержание органических веществ в воде оченивается по методикам определения окисляемости воды, содержания органического углерода, биохимической потребности в кислороде, а также поглощения в ультрафиолетовой области.
Величина, характеризующая содержание в воде органических и минеральных веществ, окисляемых одним из самых сильных окислителей при определенных условиях, называется окисляемостью. Существует несколько видов окисляемости воды: перманганатная, бихроматная, иодатная, цериевая (методики определения двух последних применяются редко).
Окислители могут действовать и на неорганические примеси, например, на ионы Fe2+, S2-, NO-2, но соотношение между этими ионами и органическими примесями в поверхностных водах существенно сдвинуто в сторону органических примесей, т.е. "органики" в решающей степени больше.
В подземных водах (артезианских) это соотношение - обратное, т.е.органических примесей гораздо меньше, чем указанных ионов. Практически их нет совсем. К тому же неорганческие примеси могут определяться непосредственно индивидуально.
Для природных малозагрезненных вод рекомендовано определять перманганатную окисляемость (перманганатный индекс); в более загрязненных водах определяют, как правило, бихроматную окисляемость (ХПК).
Окисляемость перманганатная определяется мгО/л, если учитывается масса ионов кислорода в составе перманганата калия, пошедшего на окисление "органики", или мг KMnO4/л, если оценивается количество перманганата калия, пошедшего на окисление "органики".
Таблица 12. Характеристика вод по перманганатной окисляемости
| Величина окисляемости | Единица измерения, мг О/л |
| Очень малая | до 4 |
| Малая | более 4 до 8 |
| Средняя | более 8 до 12 |
| Высокая | более 12 до 20 |
| Очень высокая | более 20 |
Интегральные показатели качества воды - индексы качества
Каждый из показателей качества воды в отдельности хотя и несет информацию о качестве воды, все же не может служить мерой качества воды, т.к. не позволяет судить о значениях других показателей. Вместе с тем, результатом оценки качества воды должны быть некоторые интегральные показатели, которые охватывали бы основные показатели качества воды (либо те из них, по которым зафиксированно неблагополучие).
 Гидрохимический индекс загрязнения воды
Гидрохимический индекс загрязнения воды
В простейшем случае, при наличии результатов по нескольким оцениваемым показателям, может быть рассчитана сумма приведенных концентраций компонентов, т.е. отношение их фактических концентраций к ПДК.
Сумма приведенных концентраций может рассчитываться только для химических веществ с одинаковыми лимитирующим показателем вредности - огранолептическим и санитарно-токсикологическим.
При наличии результатов анализов по достаточному количеству показателей можно определять классы качества воды, которые являются интегральной характеристикой загрязненности поверхностных вод. Классы качества определяются по индексу загрязнения воды (ИЗВ).
Значение ИЗВ рассчитываются для каждого пункта отбора проб (створа). Далее по таблице, в зависимости от значения ИЗВ, определяют класс качества воды.
Таблица 13. Характеристики интегральной оценки качесвта воды
| ИЗВ | Класс качества воды | Оценка качества (характеристика) воды |
| Менее и равно 0,2 | I | Очень чистые |
| Более 0,2-1 | II | Чистые |
| Более 1-2 | III | Умеренно грязные |
| Более 2-4 | IV | Загрязненные |
| Более 4-6 | V | Грязные |
| Более 6-10 | VI | Очень грязные |
| Свяше 10 | VII | Чрезвычайно грязные |
В число 7 основных, так называемых "лимитируемых" показателей, при расчете ИЗВ в обязательном порядке входят концентрация растворенного кислорода и значение БПК5, а также значения еще четырех показателей, являющихся для данного водоема (воды) наиболее не благополучными или имеющих наибольшие приведенные концентрации.
Для рассчета ИЗВ показатели выбираются независимо от лимитирующего признака вредности, однако при равенстве приведенных концентраций предпочтение отдается веществам, имеющим санитарно-токсикологический признак вредности (как правило, такие вещества обладают относительно большей вредностью).
Задачи интегральной оценки качества воды практически совпадают с задачами гидрохимического мониторинга, т.к. для окончательного вывода о классе качества воды необъодимы результаты анализов по целому ряду показателей в течение продолжительного периода.
Микробиологические показатели
Уровень загрязненности и класс качества водных объктов иногда устанавливают в зависимости от микробиологических показателей.
Таблица 14. Оценка качесвта вод по микробиологическим показателям
| Класс чистоты | Характеристика класса чистоты воды |
Общее число бактерий, 106 клеток |
Число сапрофитных бактерий, 1000 клеток/мл | Отношение общего числа бактерий к числу сапрофитных бактерий |
| I | Очень чистая | Менее 0,5 | Менее 0,5 | До 1000 |
| II | Очень чистая | От 0,5 до 1,0 | От 0,5 до 5,0 | Более 1000 |
| III | Умеренно загрязненная | Более 1,0 до 3,1 | Более 5,0 до 10,0 | От 1000 до 100 |
| IV | Умеренно загрязненная | Более 3,1 до 5,0 | Более 10,0 до 50,0 | Менее 100 |
| V | Грязная | Более 5,0 до 10,0 | Более 50,0 до 1000 | Менее 100 |
| VI | Очень грязная | Более 10,0 | Более 1000 | Менее 100 |
** Эвтрофикация (др.-греч. εὐτροφία — хорошее питание) — насыщение водоёмов биогенными элементами, сопровождающееся ростом биологической продуктивности водных бассейнов.
ГОСТ 17.1.1.01-77 Охрана природы. Гидросфера. Использование и охрана вод. Основные термины и определения
- 2525 - ГОСТ 17.1.1.01-77.pdf (504 КБ)